中年发福真正原因中年发福并非代谢变慢
中年发福的真正原因,并非基础代谢变慢?
《科学》杂志研究表明,基础代谢率在60岁之前其实变化不大,所以代谢慢并不是中年发胖的主因。
那真正的幕后推手是谁?
答案是——脂肪祖细胞(APC),特别是一种新发现的特殊亚群CP-A细胞。
简单来说:
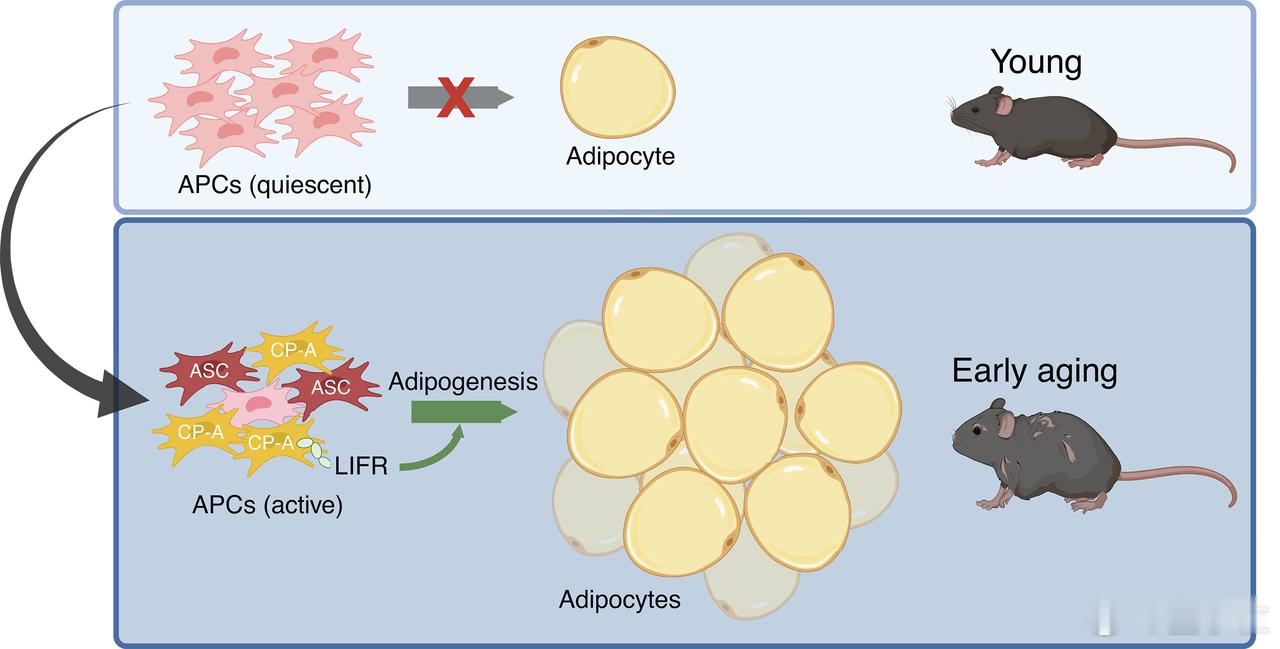
- 脂肪祖细胞(APC)是脂肪组织里的干细胞,负责不断生成新的脂肪细胞,维持脂肪组织的正常运作。
- 此前普遍认为,随着年龄增长,APC会像其他干细胞一样慢慢失活,脂肪更新减少。
- 但这项新研究在小鼠中发现,小鼠中年后(对应人类大约45岁),脂肪组织中出现了一种全新的、特别活跃的CP-A细胞亚群。
而CP-A细胞的特别之处在于:
- 增殖能力和分化能力都非常强,相比年轻时期的脂肪祖细胞,活性要高出一大截;
- 它们在小鼠9个月龄开始出现,12个月龄时爆发式增多;
- 这直接导致了脂肪细胞数量激增,脂肪组织体积膨胀。
实验结果方面,也有数据支撑:
- 中年小鼠体重明显增加,内脏脂肪增长了4.6倍,皮下脂肪增长了2.8倍;
- 内脏脂肪中超过80%的脂肪细胞,都是中年阶段新生出来的。
- 把这些中年小鼠的CP-A细胞移植到年轻小鼠体内,年轻小鼠也迅速“发福”,说明是细胞在作怪,而非代谢。
小鼠是这样,那人呢?
研究者在人类脂肪组织中,也发现了类似的脂肪祖细胞亚型,特征和小鼠的CP-A非常相似。
更进一步,科学家锁定了CP-A细胞活跃的核心开关——LIFR(白血病抑制因子受体):
- LIFR在CP-A细胞中高表达;
- 它对脂肪细胞新生至关重要;
- 抑制LIFR,可以明显降低脂肪生成,且不会影响年轻阶段APC的正常功能。
也就是说,未来如果能精准干预LIFR,就有可能专门针对中年阶段的脂肪疯长问题进行治疗,不会破坏正常脂肪组织的健康更新。
如果这条路径成立,未来中年发福,或许就不再是无法避免的“自然规律”,而是一个可以精准管理、科学干预的问题了。
文章原文: